Nội dung ôn tập môn Hóa học Lớp 10 - Chủ đề: Halogen
Bạn đang xem tài liệu "Nội dung ôn tập môn Hóa học Lớp 10 - Chủ đề: Halogen", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Nội dung ôn tập môn Hóa học Lớp 10 - Chủ đề: Halogen
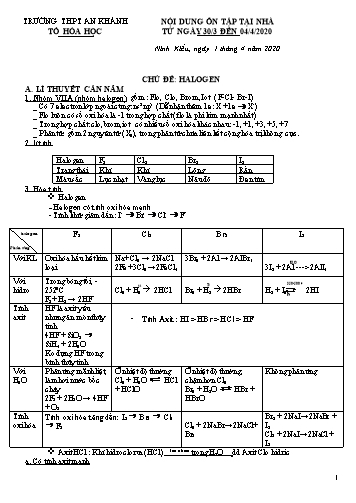
TRƯỜNG THPT AN KHÁNH TỔ HÓA HỌC NỘI DUNG ÔN TẬP TẠI NHÀ TỪ NGÀY 30/3 ĐẾN 04/4/2020 Ninh Kiều, ngày 1 tháng 4 năm 2020 CHỦ ĐỀ: HALOGEN A. LÍ THUYẾT CẦN NẮM 1. Nhóm VIIA (nhóm halogen) gồm : Flo, Clo, Brom, Iot ( F-Cl- Br-I) _ Có 7 electron lớp ngoài cùng: ns2np5 (Dễ nhận thêm 1e: X +1e X-) _ Flo luôn có số oxi hóa là -1 trong hợp chất (flo là phi kim mạnh nhất) _ Trong hợp chất: clo,brom, iot có nhiều số oxi hóa khác nhau: -1, +1, +3, +5, +7 _ Phân tử: gồm 2 nguyên tử (X2), trong phân tử chứa liên kết cộng hóa trị không cực. 2. lí tính Halogen F2 Cl2 Br2 I2 Trạng thái Khí Khí Lỏng Rắn Màu sắc Lục nhạt Vàng lục Nâu đỏ Đen tím 3. Hóa tính Halogen - Halogen có tính oxi hóa mạnh - Tính khử giảm dần : I- Br- Cl- F- Phaûn öùng halogen F2 Cl2 Br2 I2 Với KL Oxi hóa hầu hết kim loại Na+ Cl2 → 2NaCl 2Fe +3Cl2 →2FeCl3 3Br2 + 2Al → 2AlBr3 H2O 3I2 + 2Al ---> 2AlI3 Với hidro Trong bóng tối, -2520C F2+ H2 → 2HF as Cl2 + H2 à 2HCl T0 Br2 + H2 à 2HBr 350-5000 Pt H2 + I2 2HI Tính axit HF là axit yếu nhưng ăn mòn thủy tinh 4HF + SiO2 SiH4 + 2H2O Ko đựng HF trong bình thủy tinh Tính Axit : HI > HBr > HCl > HF Với H2O Phản ứng mãnh liệt, làm hơi nước bốc cháy 2F2 + 2H2O → 4HF + O2 Ở nhiệt độ thường Cl2 + H2O HCl + HClO Ở nhiệt độ thường, chậm hơn Cl2 Br2 + H2O HBr + HBrO Không phản ứng Tính oxi hóa Tính oxi hóa tăng dần: I2 Br2 Cl2 F2 Cl2 + 2NaBr→2NaCl + Br2 Br2 + 2NaI→2NaBr + I2 Cl2 + 2NaI→2NaCl + I2 Axit HCl : Khí hidroclorua (HCl) Tan nhiều trong H2O dd Axit Clo hidric a. Có tính axit mạnh + Tác dụng với kim loại trước hiddro: Fe + 2HCl FeCl2 + H2 + Tác dụng với baz ơ, oxit bazơ: CuO + 2HCl CuCl2 + H2O Fe(OH)3 + 3HCl FeCl3 + 3H2O + Tác dụng với muối của axit yếu hơn: CaCO3 + 2HCl CaCl2 + CO2 + H2O + Làm quì tím hóa đỏ b. Có tính khử: 2KMnO4 + 16HCl 2MnCl2 + 5Cl2 + 8H2O 4. Điều chế halogen F2 Điện phân dung dịch loãng KF và HF Cl2 Trong phòng thí nghiệm HCl Cl2 + chất oxi hóa ( MnO2, KMnO4..) 2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 8H2O MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O Trong công nghiệp: điện phân dd NaCl có màn ngăn 2NaCl + 2H2O điện phân dd 2NaOH + Cl2 + H2 Có màn ngăn Nếu ko có màn ngăn. Thu được nước Javen và H2 Br2 Cl2 +2NaBr 2NaCl + Br2 (NaBr có trong nước biển) I2 Trong rong biển HCl Trong phòng thí nghiệm NaCl(tinh thaå ) + H2SO4 ñaëc NaHSO4 + HCl NaCl(tinh thaå ) + H2SO4 ñaëc NaHSO4 + HCl Trong công nghiệp: Cl2 + H2 2HCl 5. Nhận biết Nhận biết X- bằng dung dịch AgNO3 AgNO3 Cl- Br - I - F- AgCl (Trắng) AgNO3 + NaCl →AgCl +NaNO3 AgBr (vàng nhạt) AgNO3 + NaBr →AgBr NaNO3 AgI (vàng) AgNO3 + NaI→AgI +NaNO3 AgF (tan) 6. Hợp chất chứa oxi của clo Nước javen: (dd chứa: NaCl và NaClO) -Tính chất: Có tính oxi hóa mạnh: dùng tẩy trắng, sát trùng. NaClO kém bền trong không khí. NaClO + CO2 + H2O NaHCO3 + HClO - Điều chế: Cl2 + 2NaOH NaCl + NaClO + H2O Hoặc điện phân dd NaCl không màn ngăn Clorua vôi: CaOCl2 hay Cl- Ca- O-Cl -Tính chất : Có tính oxi hóa mạnh: dùng sát trùng, tẩy uế. Trong không khí: 2CaOCl2 + CO2 + H2O CaCO3 + CaCl2 + 2HClO - Điều chế: Cl2 + Ca(OH)2 CaOCl2 + H2O B. BÀI TẬP VẬN DỤNG Mức độ biết Câu 1: Cấu hình e lớp2 ngoài cùng của các nguyên tử các nguyên tố halogen là A. ns2np4. B. ns2 np5. C. ns2np3. D. ns2np6. Câu 2: Nhóm halogen bao gồm các nguyên tố A. F, Cl, Br, I. B. Cl, Br, Fe, I. C. Cl, S, P, Si. D. O, S, Cl, N. Câu 3: Phân tử nào sau đây chứa liên kết cộng hóa trị không phân cực? A. H2O. B. Cl2. C. HCl. D. NaClO. Câu 4: Chọn kết luận sai? Các nguyên tố thuộc nhóm halogen có số oxi hóa -1. ngoài số oxi hóa -1 còn có các số oxi hóa +1, +3, +5,+7. có khả năng tạo ra hợp chất khí với hiđro (HF, HCl, HBr, HI). có tính oxi hóa tăng dần theo thứ tự: I, Br, Cl, F. Câu 5: Chất nào có tính khử mạnh nhất? A. HI. B. HF. C. HBr. D. HCl. Câu 6: Trong phản ứng clo với nước, clo là chất A. oxi hóa. B. khử. C. vừa oxi hóa, vừa khử. D. không oxi hóa, khử Câu 7: Thuốc thử được dùng để nhận biết axit clohidric và muối clorua là: A. AgNO3. B. Na2CO3. C. NaOH. D. phenolphthalein. Câu 8: Hợp chất nào có tính oxi hóa mạnh nhất? A. HClO. B. HClO2. C. HClO3. D. HClO4. Câu 9: Axit clohidric không tham gia phản ứng với A. Fe(OH)2. B. Cu. C. MgO. D. AgNO3. Câu 10: Tính chất hóa học đặc trưng của các nguyên tố halogen là A. tính oxi hóa yếu. B. tính oxi hóa mạnh. C. tính khử yếu. D. tính khử mạnh. Câu 11: Công thức hóa học của hidroclorua là A. HClO4. B. HClO. C. HClO3. D. HCl. Câu 12: Axit ăn mòn thủy tinh là A. axit flohidric. B. axit sunfuric. C. axit clohidric. D. axit sunfuhidric. Câu 13: Thuốc thử được dùng để nhận biết hồ tinh bột là A. axit clohidric. B. nước clo. C. nước giaven. D. dung dịch iot. Câu 14: Axit không thể đựng trong bình thủy tinh là A. HNO3 B. HF. C. H2SO4. D. HCl. Câu 15: Dung dịch AgNO3 không phản ứng với dung dịch nào sau đây? A. NaCl. B. NaBr. C. NaI. D. NaF. Câu 16: Cho phản ứng: SO2 + Cl2 + 2H2O 2HCl + H2SO4. Clo là chất A. oxi hóa. B. khử. C. vừa oxi hóa, vừa khử. D. Không oxi hóa khử Câu 17: Đặc điểm nào không phải là đặc điểm chung của các halogen? A. Đều là chất khí ở điều kiện thường. B. Đều có tính oxi hóa mạnh. C. Tác dụng với hầu hết các kim loại và phi kim. D. Khử năng tác dụng với nước giảm dần tử F2 đến I2. Câu 18: Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất A. tăng dần. B. giảm dần. C. không thay đổi. D. vừa tăng, vừa giảm. Câu 19: Nước giaven và clorua vôi có tính oxi hóa rất mạnh, nguyên nhân là do nguyên tử clo có trạng thái oxi hóa nào sau đây gây ra? A. -1. B. +1. C. +3. D. +5. Câu 20: Trong các kim loại sau đây, kim loại nào khi tác dụng với clo và axit clohidric cho cùng một loại muối? A. Zn B. Fe. C. Cu. D. Ag Câu 21: Chất nào sau đây được ứng dụng dung để tráng phim ảnh? A. NaBr. B. AgCl. C. AgBr. D. HBr. Câu 22: Dãy các chất nào sau đây đều tác dụng với axit clohidric? A. Fe2O3, KMnO4, Cu, Fe, AgNO3. B. Fe2O3, KMnO4¸Fe, CuO, AgNO3. C. Fe, CuO, H2SO4, Ag, Mg(OH)2. D. KMnO4, Cu, Fe, H2SO4, Mg(OH)2. Câu 23: Clorua vôi là A. Muối tạo bởi kim loại liên kết với một gốc axit. B. Muối tạo bởi kim loại liên kết với hai gốc axit. C. Muối tạo bởi hai kim loại liên kết với một gốc axit. D. Clorua vôi không phải là muối. Câu 24: Phản ứng điều chế khí clo trong phòng thí nghiệm A. 2NaCl 2Na + Cl2 B. F2 + 2NaCl 2NaF + Cl2 C. 4HCl + MnO2 MnCl2 + 2H2O + Cl2 D. 2HCl H2 + Cl2 Câu 25: Nước Javen được tạo thành khi cho khí clo tác dụng với dung dịch A. NaOH. B. NaCl. C. Na2CO3. D. Ca(OH)2. Câu 26: Ở điều kiện thường, clo là chất .(1).. có màu ..(2)(1) và (2) lần lượt là A. rắn, đen tím. B. lỏng, nâu đỏ. C. khí, lục nhạt. D. khí, vàng. Câu 27: Trong bảng hệ thống tuần hoàn, các nguyên tố halogen thuộc nhóm A. VIIA. B. VA. C. VIA. D. VIIIA. Câu 28: Trong phòng thí nghiệm, khí clo được điều chế bằng cách cho axit clohidric đặc tác dụng với A. CuO. B. Fe. C. CaCO3. D. MnO2. Câu 29: Công thức hóa học của clorua vôi là A. CaOCl2. B. CaCl2 . C. CaO. D. Ca(OH)2. Mức độ hiểu Câu 30: Trong phản ứng: Cl2+ 2 NaBr 2 NaCl + Br2, nguyên tố clo A. bị oxi hóa. B. bị khử. C. vừa bị oxi, vừa bị khử. D. Không bị oxi hóa, không bị khử. Câu 31: Tại sao người ta điều chế được nước clo mà không điều chế được nước flo. A. Vì flo không tác dụng với nước. B. Vì flo có thể tan trong nước. C. Vì flo có thể bốc cháy khi tác dụng với nước. D. Vì một lí do khác. Câu 32: Chất nào sau đây có độ tan tốt nhất? A. AgI. B. AgCl. C. AgBr. D. AgF. Câu 33: Thuốc thử để nhận ra iot là: A. hồ tinh bột. B. nước brom. C. phenolphthalein. D. Quì tím. Câu 34: Phản ứng nào chứng tỏ HCl là chất khử? A. HCl + NaOH NaCl + H2O. B. 2HCl + Mg MgCl2+ H2 . C. MnO2+ 4 HCl MnCl2+ Cl2 + 2H2O. D. NH3+ HCl NH4Cl. Câu 35: Cho phương trình hóa học sau: KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O. Hệ số cần bằng của các chất lần lượt là A. 2, 12, 2, 2, 3, 6. B. 2, 14, 2, 2, 4, 7. C. 2, 8, 2, 2, 1, 4. D. 2, 16, 2, 2, 5, 8. Câu 36: Clorua vôi là muối của canxi với 2 loại gốc axit là clorua Cl- và hipoclorit ClO-. Vậy clorua vôi gọi là muối gì? A. Muối trung hoà. B. Muối kép. C. Muối của 2 axit. D. Muối hỗn tạp. Câu 37: Khí Cl2 điều chế bằng cách cho MnO2 tác dụng với dd HCl đặc thường bị lẫn tạp chất là khí HCl. Có thể dùng dd nào sau đây để loại tạp chất là tốt nhất? A. Dd NaOH. B. Dd AgNO3. C. Dd NaCl. D. Dd KMnO4. Câu 38: Chất nào sau đây chỉ có tính oxi hoá, không có tính khử? A. F2. B. Cl2. C. Br2. D. I2. Câu 39: Có 4 chất bột màu trắng là vôi bột, bột gạo, bột thạch cao (CaSO4.2H2O) bột đá vôi (CaCO3). Có thể nhận biết ngay được bột gạo bằng dung dịch A. HCl. B. H2SO4 loãng. C. Br2. D. I2. Câu 40: Hiện tượng ta gọi là A. sự phân hủy. B. sự chuyển trạng thái. C. sự thăng hoa. D. sự bay hơi. Câu 41: Cho dung dịch chứa 1g HBr vào dung dịch chứa 1g NaOH. Nhúng quỳ tím vào dung dịch sau phản ứng, quỳ tím chuyển sang màu A. hồng. B. Xanh. C. cam. D. đỏ. Câu 42: Clo không oxi hóa được cặp chất A. N2 và O2. B. KI và KBr. C. H2 và CO. D. Fe và Cu. Câu 43: Clo không phản ứng với chất nào sau đây? A. NaOH B. NaCl C. Ca(OH)2 D. NaBr Câu 44: Dãy gồm các chất đều tác dụng được với dung dịch HCl loãng là A. Mg(HCO3)2, HCOONa, CuO. B. AgNO3, (NH4)2CO3, CuS. C. KNO3, CaCO3, Fe(OH)3. D. FeS, BaSO4, KOH. Vận dụng Câu 45: Cho 14,2 gam KMnO4 tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được ở (đktc) là A. 0,56 l. B. 5,0 l. C. 4,48 l. D. 8,96 l. Câu 46: Hòa tan 12,8 gam hh Fe, FeO bằng dung dịch HCl 0,1M vừa đủ, thu được 2,24 lít (đktc). Thể tích dung dịch HCl đã dùng là A. 14,2 lít. B. 4,0 lít. C. 4,2 lít. D. 2,0 lít. Câu 47: Sục 1,12 lít khí clo (đktc) vào dung dịch NaOH 1M. Sau khi phản ứng kết thúc, thể tích dung dịch NaOH cần dùng là A. 0,1 lít. B. 0,05 lít. C. 0,15 lít. D. 0,3 lít. Câu 48: Cho 4,2 gam hỗn hợp gồm Mg và Zn tác dụng hết với dung dịch HCl, thấy thoát ra 2,24 lít khí H2 (đktc). Khối lượng muối khan thu được là A. 11,3 gam. B. 7,75 gam. C. 7,1 gam. D. kết quả khác. Câu 49: Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối clorua tạo ra trong dung dịch là bao nhiêu gam? A. 80 gam. B. 115,5 gam. C. 51,6 gam. D. kết quả khác. Câu 50: Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe bằng dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí (đktc) và dung dịch X. Cô cạn dung dịch X thì thu được bao nhiêu gam muối khan? A. 71,0 gam. B. 90,0 gam. C. 55,5 gam. D. 91,0 gam. -----------------------------------------------
File đính kèm:
 noi_dung_on_tap_mon_hoa_hoc_lop_10_chu_de_halogen.doc
noi_dung_on_tap_mon_hoa_hoc_lop_10_chu_de_halogen.doc

