Luyện tập Hóa Học Lớp 12 - Chương: Kim loại kiềm- Kiềm thổ- Nhôm
Bạn đang xem tài liệu "Luyện tập Hóa Học Lớp 12 - Chương: Kim loại kiềm- Kiềm thổ- Nhôm", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Luyện tập Hóa Học Lớp 12 - Chương: Kim loại kiềm- Kiềm thổ- Nhôm
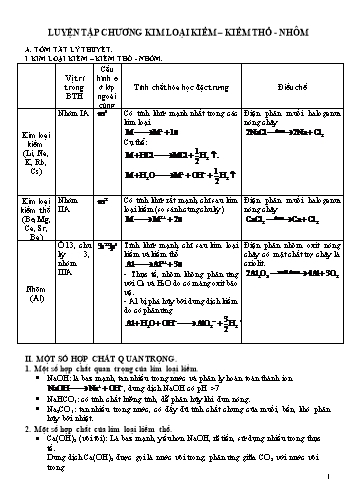
LUYỆN TẬP CHƯƠNG KIM LOẠI KIỀM – KIỀM THỔ - NHÔM A. TÓM TẮT LÝ THUYẾT. I. KIM LOẠI KIỀM – KIỀM THỔ - NHÔM. Vị trí trong BTH Cấu hình e ở lớp ngoài cùng Tính chất hóa học đặc trưng Điều chế Kim loại kiềm (Li, Na, K, Rb, Cs) Nhóm IA Có tính khử mạnh nhất trong các kim loại Cụ thể: Điện phân muối halogenua nóng chảy Kim loại kiềm thổ (Be, Mg, Ca, Sr, Ba) Nhóm IIA Có tính khử rất mạnh, chỉ sau kim loại kiềm (so sánh cùng chu kỳ) Điện phân muối halogenua nóng chảy Nhôm (Al) Ô 13, chu kỳ 3, nhóm IIIA Tính khử mạnh, chỉ sau kim loại kiềm và kiềm thổ - Thực tế, nhôm không phản ứng với O2 và H2O do có màng oxit bảo vệ. - Al bị phá hủy bởi dung dịch kiềm do có phản ứng Điện phân nhôm oxit nóng chảy có mặt chất trợ chảy là criolit. II. MỘT SỐ HỢP CHẤT QUAN TRỌNG. 1. Một số hợp chất quan trọng của kim loại kiềm. NaOH: là baz mạnh, tan nhiều trong nước và phân ly hoàn toàn thành ion , dung dịch NaOH có pH >7 NaHCO3: có tính chất lưỡng tính, dễ phân hủy khi đun nóng. Na2CO3: tan nhiều trong nước, có đầy đủ tính chất chung của muối, bền, khó phân hủy bởi nhiệt. 2. Một số hợp chất của kim loại kiềm thổ. Ca(OH)2 (vôi tôi): Là baz mạnh, yếu hơn NaOH, rẽ tiền, sử dụng nhiều trong thực tế. Dung dịch Ca(OH)2 được gọi là nước vôi trong, phản ứng giữa CO2 với nước vôi trong (dung dịch bị đục) Sau đó dung dịch trong lại khi CO2 dư và phản ứng đến cùng CaCO3 (đá vôi): rất ít tan trong nước, bị phân hủy khi đun nóng ở nhiệt độ cao, tan trong dung dịch axit mạnh, tan trong nước có chứa CO2. CaSO4 (thạch cao): Tùy thuộc vào lượng nước kết tinh có trong thành phần thạch cao mà ta có 3 loại - Thạch cao sống: - Thạch cao nung: - Thạch cao khan: 3. Nước cứng. - Khái niệm: Nguồn nước có chứa nhiều ion và được gọi là nước cứng. Nguồn nước không chứa hoặc chứa ít hai ion trên được gọi là nước mềm. - Phân loại: + Nước cứng tạm thời có chứa muối + Nước cứng vĩnh cửu: chứa muối clorua và sunfat của canxi, magie. + Nước cứng toàn phần: có cả tính cứng tạm thời và vĩnh cữu. - Phương pháp làm mềm nước cứng: + Phương pháp kết tủa. + Phương pháp trao đổi ion. 4. Hợp chất của nhôm. Nhôm oxit () là chất rắn màu trắng bạc giống nhôm, rất bền, không tan trong nước, không thấm nước, có tính chất lưỡng tính. Nhôm hidroxit () là hidroxit có tính chất lưỡng tính, nó tan dung dịch axit và dung dịch kiềm mạnh. Al(OH)3 bị phân hủy khi đun nóng. Nhôm sunfat: - Phèn chua: là phèn nhôm – kali có công thức ; viết gọn: - Một số loại phèn nhôm khác, nhưng không phải là phèn chua có công thức viết gọn là B. CÂU HỎI ÔN TẬP. Đề nghị học sinh tự giải các câu hỏi ôn tập này để kiểm tra 15 phút trực tuyến vào ngày 14/02/2020. Mong các em ôn tập nghiêm túc. I. MỨC ĐỘ NHẬN BIẾT. Câu 1: Kim loại không phản ứng với axit HNO3 đặc, nguội nhưng tác dụng với dung dịch NaOH là A. Al. B. Zn. C. Cu. D. Fe. Câu 2: Chất nào sau đây không khử được FeO ở nhiệt độ cao? A. Cu. B. Al. C. CO. D. H2. Câu 3: Cấu hình electron lớp ngoài cùng của các nguyên tử kim loại kiềm là A. ns1. B. ns2. C. ns2np1. D. ns2np5. Câu 4: Thành phần chính của đá vôi là A. CaSO4. B. CaO. C. CaCO3. D. Ca(OH)2. Câu 5: Muối nào sau đây không bị phân hủy khi đun nóng ở nhiệt độ cao? A. NaHCO3. B. KNO3. C. CaCO3. D. Na2CO3. Câu 6: Thành phần hóa học chính của thạch cao sống là A. CaSO4.H2O. B. CaSO4.2H2O. C. 2CaSO4.H2O. D. CaSO4. Câu 7: Hòa tan phèn chua vào nước thu được dung dịch X. Nhỏ từ từ đến dư dung dịch Y vào X thì thu được kết tủa. Y là dung dịch A. HCl. B. NaOH. C. NH3. D. MgCl2. Câu 8: Quặng nào sau đây là quặng chứa nhôm oxit? A. Hematit. B. Xiđerit. C. Pirit. D. Boxit. Câu 9: Hỗn hợp tecmit gồm bột kim loại X và bột sắt oxit được sử dụng để hàn đường ray. Kim loại X là A. Zn. B. Al. C. Cu. D. Ag. Câu 10: Canxioxit không phản ứng với A. B. C. D. Câu 11: Dung dịch nào sau đây có pH > 7? A. HCl. B. KHSO4. C. NaOH. D. KNO3. Câu 12: Kim loại nào sau đây có màu trắng bạc, dễ kéo sợi, dễ dát mỏng, thường được sử dụng làm giấy gói kẹo? A. Đồng. B. Chì. C. Sắt. D. Nhôm. Câu 13: Ở trạng thái rắn, canxi hiđroxit còn được gọi là A. thạch cao. B. vôi bột. C. đá vôi. D. vôi tôi. Câu 14: Một loại nước cứng có chứa các ion: Dung dịch nào sau đây có thể làm mềm loại nước cứng trên? A. Na3PO4. B. Ca(OH)2. C. NaOH. D. H2SO4. Câu 15: Công thức hóa học của nhôm sunfat là A. . B. C. D. Câu 16: Để phân biệt hai dung dịch BaCl2 và KCl, có thể dùng dung dịch nào sau đây? A. NH3. B. NaOH. C. Na2SO4. D. AgNO3. Câu 17: Điện phân nóng chảy NaCl với điện cực trơ, ở anot thu được A. khí Cl2. B. kim loại Na. C. khí H2. D. khí O2. Câu 18: Chất nào sau đây tác dụng với dung dịch Ba(OH)2 tạo ra kết tủa? A. NaCl. B. Ca(HCO3)2. C. KCl. D. KNO3. Câu 19: Kim loại nào sau đây tan hết trong nước dư ở nhiệt độ thường? A. Na. B. Fe. C. Mg. D. Al. Câu 20: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch? A. CuSO4. B. MgCl2. C. FeCl3. D. AgNO3. II. MỨC ĐỘ HIỂU. Câu 21: Điện phân dung dịch CuSO4 (điện cực trơ) ở catot thu được A. kim loại Cu. B. Khí O2. C. Khí H2. D. Khí CO2. Câu 22: Hiện tượng quan sát được khi cho từ từ dung dịch Ba(OH)2 đến dư vào dd Al2(SO4)3? A. thấy xuất hiện kết tủa, tăng dần đến cực đại, đồng thời xuất hiện bọt khí. B. xuất hiện kết tủa, đồng thời dung dịch tách lớp. C. thấy xuất hiện kết tủa, tăng dần đến cực đại, sau đó giảm dần nhưng kết tủa không tan hết D. thấy xuất hiện kết tủa, tăng dần đến cực đại, sau đó tan dần đến hết, dd trong suốt Câu 23: Dãy gồm các chất nào sau đây đều phản ứng được với dung dịch FeCl3? A. Mg, CuO, KOH. B. K, AgNO3, NaOH. C. Ca, KOH, HNO3. D. Na, MgO, AgNO3. Câu 24: Hỗn hợp X gồm Al, Cu và Fe3O4 (các chất có tỉ lệ mol bằng nhau). Hỗn hợp X có thể tan hoàn toàn trong dung dịch A. NaOH. B. HCl. C. AgNO3 D. NH3. Câu 25: Có 4 ống nghiệm đựng riêng biệt 4 dung dịch sau: CuCl2, Na2SO4, FeCl3, AlCl3. Cho từ từ đến dư dung dịch Ba(OH)2 vào 4 ống nghiệm trên, số ống nghiệm thu được kết tủa là A. 4. B. 2. C. 1. D. 3. Câu 26: Vôi bột (vôi sống) là một hợp chất rất quan trọng, được sử dụng rộng rãi trong đời sống. Trong công nghiệp, người ta sản xuất vôi bột bằng cách A. nung CaCO3 ở nhiệt độ cao. B. nung Ca(OH)2 ở nhiệt độ cao. C. hòa tan CaO vào nước. D. Sục khí CO2 đến dư vào nước vôi trong. Câu 27: Hai chất nào sau đây đều có thể làm mất tính cứng tạm thời của nước? A. HCl, Na3PO4. B. NaCl, Na2CO3. C. Ca(OH)2, Na2CO3. D. H2SO4, Ca(OH)2. Câu 28: Hoà tan hoàn toàn kim loại X bằng dung dịch H2SO4 loãng, thu được dung dịch Y. Cho từ từ đến dư dung dịch NaOH vào Y, sau phản ứng thu được dung dịch trong suốt. X là kim loại nào sau đây? A. Fe. B. Cu. C. Al. D. Mg. Câu 29: Nung hỗn hợp A gồm Al, CuO, MgO và Fe2O3 trong điều kiện không có không khí thu được hỗn hợp rắn X. Hòa tan X trong dd NaOH thì thấy có bọt khí thoát ra (các phản ứng xảy ra hoàn toàn). Thành phần của chất rắn X gồm A. Al, Al2O3, Mg, Cu, Fe. B. Al, Al2O3, Mg, CuO, Fe. C. Al2O3, MgO, CuO, Fe. D. Al, Al2O3, MgO, Cu, Fe. Câu 30: Tiến hành các thí nghiệm sau: (1) Cho Zn tác dụng với dung dịch AgNO3. (2) Cho mặt Fe tác dụng với lượng dư dung dịch Fe2(SO4)3. (3) Cho Na tác dụng với dung dịch CuSO4. (4) Dẫn khí CO qua bột CuO, đun nóng. Sau khi phản ứng xong, các thí nghiệm thu được kim loại là A. (1) và (2). B. (3) và (4). C. (2) và (3). D. (1) và (4). Câu 31: Hoà tan hỗn hợp gồm: K2O, BaO, Al2O3 và Fe3O4 vào nước (dư), thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là A. Al(OH)3. B. Fe(OH)3. C. BaCO3. D. K2CO3. Câu 32: Cho sơ đồ chuyển hóa: CaCO3 → X → Y → Z → CaCO3. Các chất X, Y, Z lần lượt là A. CO2, KHCO3, BaCl2. B. CaCl2, KHCO3, Ca(HCO3)2 C. Ca(OH)2, KHCO3, K2CO3, D. CO2, Ba(HCO3)2, K2CO3. Câu 33: Cho phương trình phản ứng hóa học: aMg + bHNO3 → cMg(NO3)2 + dNH4NO3 + eH2O. Tổng (b+d) là A. 12. B. 10. C. 14. D. 11. Câu 34: Tiến hành các thí nghiệm sau: (a) Nhỏ vài giọt dung dịch NaCl vào dung dịch AgNO3. (b) Nhỏ vài giọt dung dịch NaHSO4 vào dung dịch BaCl2. (c) Dẫn khí CO2 đến dư vào dung dịch Ca(OH)2. (d) Nhỏ vài giọt dung dịch NaOH vào dung dịch Ca(HCO3)2. (e) Cho dung dịch NaOH đến dư vào dung dịch AlCl3. Số lượng thí nghiệm thu được kết tủa là A. 1. B. 2. C. 4. D. 3. Câu 35: Phát biểu nào sau đây sai? A. Cho dung dịch NaOH vào nước cứng tạm thời, thấy xuất hiện kết tủa trắng. B. Phương pháp trao đổi ion có thể làm mềm nước cứng toàn phần. C. Không thể dùng vật liệu bằng nhôm để chứa dung dịch HNO3 đặc, nguội. D. Dung dịch Al2(SO4)3 có thể làm quỳ tím hóa đỏ. Câu 36: Cho hỗn hợp gồm Cu và Fe3O4 vào lượng dư dung dịch H2SO4 loãng, thu được chất rắn X và dung dịch Y. Cho lượng dư dung dịch NaOH vào Y, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được chất rắn T. Biết các phản ứng xảy ra hoàn toàn. Chất rắn T là A. CuO và Fe2O3. B. Fe 2O3. C. FeO và Fe2O3. D. FeO và CuO. Câu 37: Để loại bỏ các khí HCl, CO2 và SO2 có lẫn trong khí N2, người ta sử dụng lượng dư dung dịch A. NaCl. B. CuCl2. C. Ca(OH)2. D. H2SO4. Câu 38: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là A. H2. B. CO2. C. N2. D. O2. Câu 39: Thực hiện các thí nghiệm sau: a) Sục khi CO2 dến dư vào dung dịch NaAlO2. b) Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. c) Cho từ từ đến dư dung dịch NaOH vào dung dịch Al2(SO4)3. d) Cho từ từ đến dư dung dịch HCl vào dung dịch KAlO2. e) Cho dung dịch AlCl3 đến dư vào dung dịch NaOH. f) Cho dung dịch NaAlO2 đến dư dung dịch HCl. Số thí nghiệm thu được Al(OH)3 là A. 4. B. 3. C. 5. D. 2. Câu 40: Hỗn hợp X chứa Cu và Fe3O4 (tỉ lệ mol 1: 1) trong lượng vừa đủ dung dịch HCl, sau phản ứng thu được dung dịch Y. Các chất tan trong Y gồm có A. B. C. D. III. PHẦN VẬN DỤNG THẤP. Câu 41: Hòa tan hoàn toàn hỗn hợp Na, Ba vào nước thu được dung dịch X và 0,672 lít khí (đktc). Thể tích dung dịch HCl 1M cần dùng để trung hòa dung dịch X là A. 30 ml. B. 15 ml. C. 90 ml. D. 60 ml. Câu 42: Hòa tan hoàn toàn 9,36 gam một kim loại M vào nước thì thu được 2,688 lít khí (đktc). Kim loại M là A. K. B. Ba. C. Na. D. Ca. Câu 43: Cho 100ml dd NaOH 1M tác dụng với 15ml dung dịch Al2(SO4)3 1M thì thu được x mol kết tủa. Giá trị của x là A. 0,03. B. 0,01. C. 0,02. D. 0,05. Câu 44: Cho từ từ 300 ml dung dịch HCl 1M vào 100 ml dung dịch NaAlO2 1M, thu được m gam kết tủa. Giá trị m là A. 2,6. B. 2,7. C. 3,9. D. 7,8. Câu 45: Cho 20,8g hỗn hợp gồm Fe, CaO, MgO tác dụng vừa đủ với 400 ml dd HCl 2M thu được dd Y. Khối lượng muối MgCl2 có trong Y là A. 28,5g. B. 9,5g. C. 49,1g. D. 42,8g. Câu 46: Hòa tan hoàn toàn m gam hỗn hợp NaHCO3 và MgCO3 bằng lượng dư dd H2SO4 loãng, thu được 3,36 lít khí CO2 (đktc). Giá trị của m là A. 8,4. B. 12,6. C. 25,2. D. 6,3. Câu 47: Cho 10g hỗn hợp X gồm Al và Al2O3 tác dụng với lượng dư dung dịch NaOH, đến khi phản ứng xảy ra hoàn toàn thu được 3,36 lít khí (đktc). Thành phần phần trăm khối lượng của Al2O3 trong X là A. 40,5%. B. 27%. C. 73%. D. 13,5%. Câu 48: Dung dịch X chứa 0,01 mol H2SO4 và 0,01 mol Al2(SO4)3. Thể tích dung dịch NaOH 1M cần thêm vào X để thu được lượng kết tủa lớn nhất là A. 80 ml. B. 60 ml. C. 70 ml. D. 100 ml. Câu 49: Trộn 6,48 gam Al với 16 gam Fe2O3. Thực hiện phản ứng nhiệt nhôm thu được chất rắn X. Cho X tác dụng NaOH dư thu được 1,344 lít khí H2 (đktc). Hiệu suất phản ứng nhiệt nhôm là A. 100%. B. 85%. C. 80%. D. 75%. Câu 50: Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X trong dung dịch HCl dư, thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là A. 32,58. B. 33,39. C. 31,97. D. 34,1.
File đính kèm:
 luyen_tap_hoa_hoc_lop_12_chuong_kim_loai_kiem_kiem_tho_nhom.doc
luyen_tap_hoa_hoc_lop_12_chuong_kim_loai_kiem_kiem_tho_nhom.doc

