Đề kiểm tra Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)
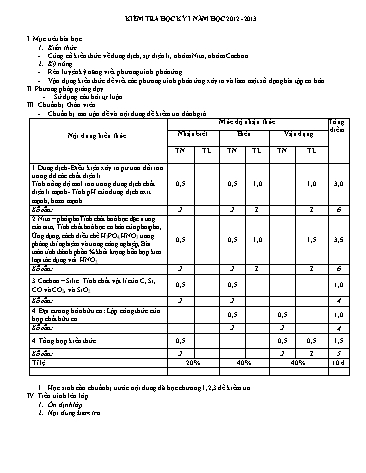
KIỂM TRA HỌC KỲ I NĂM HỌC 2012 - 2013 I. Mục tiêu bài học Kiến thức Củng cố kiến thức về dung dịch, sự điện li, nhóm Nitơ, nhóm Cacbon Kỹ năng Rèn luyện kỹ năng viết phương trình phản ứng. Vận dụng kiến thức để viết các phương trình phản ứng xảy ra và làm một số dạng bài tập cơ bản. II. Phương pháp giảng dạy Sử dụng câu hỏi tự luận III. Chuẩn bị Giáo viên Chuẩn bị ma trận đề và nội dung đề kiểm tra đánh giá. Nội dung kiến thức Mức độ nhận thức Tổng điểm Nhận biết Hiểu Vận dụng TN TL TN TL TN TL 1.Dung dịch- Điều kiện xảy ra pư trao đổi ion trong dd các chất điện li. Tính nồng độ mol ion trong dung dịch chất điện li mạnh- Tính pH của dung dịch axit mạnh, bazơ mạnh. 0,5 0,5 1,0 1,0 3,0 Số câu: 2 2 1 1 6 2. Nitơ – phôtphoTính chất hoá học đặc trưng của nitơ, Tính chất hoá học cơ bản của photpho, Ứng dụng, cách điều chế H3PO4, HNO3 trong phòng thí nghiệm và trong công nghiệp, Bài toán tính thành phần % khối lượng hỗn hợp kim loại tác dụng với HNO3. 0,5 0,5 1,0 1,5 3,5 Số câu: 2 2 1 1 6 3.Cacbon – Silic. Tính chất vật lí của C, Si, CO và CO2, và SiO2 0,5 0,5 1,0 Số câu: 2 2 4 4. Đại cương hóa hữu cơ: Lập công thức của hợp chất hữu cơ 0,5 0,5 1,0 Số câu: 2 2 4 4. Tổng hợp kiến thức 0,5 0,5 0,5 1,5 Số câu: 2 2 1 5 Tỉ lệ 20% 40% 40% 10 đ Học sinh cần chuẩn bị trước nội dung đã học chương 1,2,3 để kiểm tra. IV. Tiến trình lên lớp Ổn định lớp Nội dung kiểm tra TRƯỜNG THPT CHUYÊN BẮC KẠN KIỂM TRA HỌC KỲ I NĂM HỌC 2012 - 2013 Họ tên:............................................................................................... Lớp: ................................. MÔN HOÁ HỌC - LỚP 11 Thời gian làm bài: 45 phút ( không kể thời gian phát đề) A. Phần trắc nghiệm: (Cho Ag = 108; Mg =24; Al=27; O =16, Na =23; H=1; C= 12) 1). Trong các cặp chất sau đây cặp chất nào cùng tồn tai trong dd ? A. NaAlO2 và KOH. B. NaCl và AgNO3. C. AlCl3 và Na2CO3. D. HNO3 và NaHCO3. 2). Trong các dd: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, dãy gồm các chất đều tác dụng được với dd Ba(HCO3)2 là: A. HNO3, Ca(OH)2, KHSO4, Mg(NO3)2. B. NaCl, Na2SO4, Ca(OH)2. C. HNO3, Ca(OH)2, KHSO4, Na2SO4. D. HNO3, NaCl, Na2SO4. 3). Dung dịch NaOH có pH = 9.Pha loãng dd 10 lần bằng nước thì dd mới pH bằng? A. 9 B. 8 C. 10 D. 11 4). Cho các chất: Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, K2SO3, (NH4)2CO3. Số chất là chất lưỡng tính là: A. 4 B. 6 C. 5 D. 3 5). Phương trình phản ứng nào sau đây sai? A. FeS + ZnCl2 " ZnS + FeCl2. B. Na2SO4 + BaCl2 " BaSO4 + 2NaCl C. FeS + 2HCl " FeCl2 + H2S. D. 2HCl + Mg(OH)2 " MgCl2 + 2H2O 6). Có bao nhiêu dung dịch có PH<7 trong các dung dịch sau đây: K2SO4, NH4NO3, CuSO4, NaHCO3, CH3COOH, KHSO4 , BaCl2, Ca(NO3)2, HClO, Na3PO4, H2SO4. A. 8 B. 5 C. 6 D. 7 7). Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,05M với 300 ml dung dịch Ba(OH)2 nồng độ x M thu được m gam kết tủa và 500 ml dung dịch có pH = 13. Giá trị của x và m lần lượt là A. x = 0,150; m = 2,33 B. x = 0,020; m = 3,23. C. x = 0,015; m = 2,33. D. x = 0,200; m = 3,23. 8). Xác định chất (A) và (B) trong chuỗi sau : N2 NH3 (A) (B) HNO3. A. (A) là N2, (B) là N2O5. B . (A) là NO, (B) là N2O5. C. (A) là N2, (B) là NO2. D. (A) là NO, (B) là NO2. 9). NH3 có thể phản ứng được với tất cả các chất trong nhóm nào sau đây (các đk coi như có đủ ): A. HCl ,O2 , Cl2 , CuO ,dd AlCl3. B. HCl , KOH , FeCl3 , Cl2. C. H2SO4 , PbO, FeO ,NaOH. D. KOH , HNO3 , CuO , CuCl2. 10). Nhóm các muối nào khi nhiệt phân cho ra kim loại, khí NO2 và khí O2 ? A. AgNO3, Fe(NO3)2, Zn(NO3)2. B. AgNO3, Cu(NO3)2, Zn(NO3)2. C. AgNO3, Pt(NO3)2, Hg(NO3)2. D. NaNO3, Ca(NO3)2, KNO3. 11). Hòa tan hỗn hợp gồm FeS và FeCO3 bằng dung dịch HNO3 loãng thì thu được hỗn hợp X gồm hai chất khí. Tỉ khối của X so với O2 là 1,375. Hỗn hợp X gồm: A. CO ; N2. B. CO2 ; N2O C. NO ; N2O D. CO2 ; NO 12). Hòa tan 1,2 gam kim loại X vào HNO3 ta thu được sản phẩm gồm muối của kim loại, nitơ và nước. Thể tích khí nitơ là 0,224 lit( ĐKC). X là: A. Mg B. Al C. Zn D. Cu 13). Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây ( Điều kiện coi như có đủ)? A. KOH, HNO3, CuO, CuCl2. B. H2SO4,PbO, FeO, NaOH C. HCl, O2, Cl2, CuO, AlCl3. D. HCl, KOH, FeCl3, Cl2. 14). Chọn câu phát biểu sai: A. Nhận biết các dung dịch: K3PO4, KCl; KNO3 ta có thể dùng AgNO3. B. Nhận biết các dung dịch Al2(SO4)3; K3PO4; NaNO3 ta có thể dùng quỳ tím C. Nhận biết các dung dịch HNO3, H2SO4, H3PO4 bằng dung dịch Ba(OH)2. D. Nhận biết N2, NH3 , H2 bằng CuO nung nóng 15). Cho hỗn hợp FeS và Cu2S hòa tan hết trong HNO3. Sau đó tiếp tục cho NH3 vào đến dư ta được chất kết tủa A. Kết tủa A gồm những chất nào sau đây? A. Fe(OH)3. B. Fe(OH)3, Cu(OH)2. C. Fe(OH)2, Cu(OH)2. D. Fe(OH)3, Cu(OH)2. 16). Cho phản ứng: Fe2+ + 2H+ + NO3- → Fe3+ + NO2 + H2O Câu phát biểu nào sau đây đúng? A. Fe2+ bị oxi hóa và N+5 (trong NO3-) bị khử B. H+ và O-2 (trong NO3- bị khử) C. Fe3+ và H+ bị khử D. Fe2+ và H+ bị oxi hóa 17). Hấp thụ hết V lit khí CO2 (đktc) vào 500ml dd Ca(OH)2 1M thấy có 25 gam kết tủa. Giá trị của V là: A. 16,8lit B. 5,6lit và 16,8lit C. 11,2lit D. 5,6lit 18). Thể tích hơn của 4,6 gam một chất hữu cơ A bằng thể tích của 1,6 gam oxi trong cùng điều kiện nhiệt độ và áp suất. Khối lượng mol phân tử của A là: A. 46 B. 23 C. 92 D. 115 19). Đốt cháy hoàn toàn 1,5 g chất hữu cơ X thu đư ợc 1,76 gam CO2, 0,9 gam H2O và 112ml N2 ở 00C và 2atm. Mặt khác nếu hoá hơi 3 g X thì thu đ ợc 0,8 lít hơi X ở 1270C và 1,64atm. Tìm công thức phân tử của X. A. C2H5O2N. B. C2H5ON. C. C2H6O2N. D. C2H6O2N2. 20). Đốt cháy hoàn toàn 4,1 gam chất hữu ơ A người ta thu được 2,65 gam Na2CO3, 1,35 gam H2O, và 1,68 lít CO2 (đktc). Công thức đơn giản nhất của A là: A. C2H4O2Na. B. C2H3O2Na. C. C2H5ONa. D. C3H4O2Na. B. Phần tự luận Hãy giải ngắn gọn các câu sau: Câu 1. (1,0 điểm ) Cho 400 ml dung dịch hỗn hợp gồm NaOH 0,05 M và Ba(OH)2 0,025 M . Tính pH của dung dịch? Câu 2. ( 1,0 điểm ) Dẫn 1,12 lít khí CO2 (đktc) vào 50ml dd NaOH 1,5 M . Tính khối lượng của muối thu được sau phản ứng? Câu 3. (1,5 điểm). Cho 13,8 gam gam hỗn hợp gồm Mg và Al2O3 phản ứng hoàn toàn với dung dịch HNO3 1 M thu được 6,72 lít khí NO2 (đktc) là sản phẩm khử duy nhất thoát ra . a) Tính % khối lượng của mỗi chất trong hỗn hợp ban đầu. b) Tính thể tích dung dịch HNO3 ban đầu biết đã lấy dư 10% Câu 4. (0,5 điểm). Cho luồng khí CO dư qua ống sứ đựng hỗn hợp các chất rắn Fe2O3, MgO, CuO, Al2O3 thì thu được chất rắn (Z). Cho biết thành phần của (Z) và viết phương trình minh họa. Câu 5. ( 1,0 điểm) Cho 8,64 gam Ag vào 120 ml dung dịch hỗn hợp gồm H2SO4 0,4 M và NaNO3 0,6 M. Đun nóng để phản ứng xảy ra hoàn toàn thì thu được V ml khí NO (đktc) là sản phẩm khử duy nhất. Tính V HƯỚNG DẪN CHẤM Phần trắc nghiệm: (5,0 điểm ) Mỗi ý đúng 0,25 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 ĐA A C B A A C A D A C B A C D A A B C A B Phần Tự luận: (5,0 điểm ) Câu 1: (1,0 điểm )Trộn 400ml dung dịch hỗn hợp NaOH 0,05 M và Ba(OH)2 0,025 M . Tính pH của dung dịch thu được ? Viết phương trình điện li : NaOH → Na+ + OH- Ba(OH)2→ Ba2+ + 2OH- Số mol OH- : [(0,05 . 0,4 ) + 2(0,025 . 0,4 )] = 0,04 mol [OH-] = 0,04/ 0,4 = 0,1 M → [H+] = 10-13 → pH = 13 0,5 điểm 0,25 điểm 0,25 điểm Câu 2: (1 điểm) Dẫn 1,12 lít khí CO2 (đktc) vào 50ml dd NaOH 1,5 M . Tính khối lượng của muối thu được sau phản ứng ? Lập tỉ lệ : n NaOH / nCO2 = (0,05 . 1,5) / (1,12: 22,4) = 1,5 → tạo hỗn hợp 2 muối ; NaHCO3, Na2CO3 0,25 điểm Viết phản ứng xảy ra :CO2 + NaOH→ NaHCO3 CO2 + 2NaOH→ Na 2CO3+ H2O 0,25 điểm Gọi x,y lần lượt là số mol của NaHCO3, Na2CO3 Lập hệ : x + y = 1,12: 22,4 = 0,05 và x + 2y = 0,075 0,25 điểm Giải hệ ta được x= 0,025 → KL NaHCO3 = 84. 0,025 = 2,1 gam y= 0,025 → KL Na2CO3 = 106. 0,025 = 2,65 gam 0,25 điểm Câu 3(1,5điểm) Viết 2 phản ứng xảy ra : Mg + 4 HNO3 đ → Mg(NO3)2 + 2NO2 + 2H2O Al2O3 + 6HNO3 đ → 2Al(NO3)3 + 3H2O Số mol khí NO2 : 6,72/ 22,4 = 0,3 mol → Số mol Mg : 0,15 mol ; KL Mg = 0,15 . 24 =3,6 gam KL Al2O3 : 13,8 - 3,6 = 10,2 gam a) → % Al2O3 = 73,9 % 0,25 điểm 0,25 điểm 0,5 điểm b) Số mol Al2O3 = 0,1 mol Số mol khí HNO3 = 4. 0,15 + 0,1 . 6 = 1,2 mol 0,25 điểm V dung dịch HNO3 cần dùng : (1,2 : 1 ) + 10 % .1,2 = 1,32 lít 0,25 điểm Câu 4. (0,5điểm) Thành phần Z gồm Cu, Fe, MgO, Al2O3 Fe2O3 + CO → Fe + CO2 CuO + CO → Cu +CO2 MgO + CO → ko xảy ra. Al2O3 + CO → ko xảy ra. 0,25 điểm 0,25 điểm Câu 5. (1điểm) Tính số mol Ag 0,08 mol; H+ 0.096 mol; NO3– 0,072 mol 3Ag + 4H+ + NO3-→ 3Ag+ + NO + 2H2O So sánh số mol H+ hết → VNO = ( 0.096/4)22,4 = 537,6 ml 0,25 điểm 0,25 điểm 0,5 điểm
File đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_11_nam_hoc_2012_2013_co.doc
de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_11_nam_hoc_2012_2013_co.doc

