Đề kiểm tra Học kì I môn Hóa học Lớp 10 (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra Học kì I môn Hóa học Lớp 10 (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra Học kì I môn Hóa học Lớp 10 (Có đáp án)
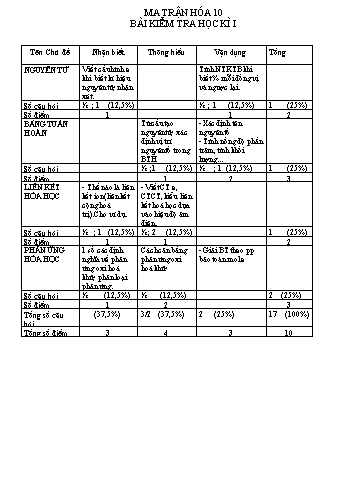
MA TRẬN HÓA 10 BÀI KIỂM TRA HỌC KÌ I Tên Chủ đề Nhận biết Thông hiểu Vận dụng Tổng NGUYÊN TỬ Viết cấu hình e khi biết kí hiệu nguyên tử, nhận xét. Tính NTKTB khi biết % mỗi đồng vị và ngược lại. Số câu hỏi ½ ; 1 (12,5%) ½ ; 1 (12,5%) 1 (25%) Số điểm 1 1 2 BẢNG TUẦN HOÀN Từ cấu tạo nguyên tử, xác định vị trí nguyên tố trong BTH -Xác định tên nguyên tố - Tính nồng độ phần trăm, tính khối lượng... Số câu hỏi ½ ;1 (12,5%) ½ ; 1 (12,5%) 1 (25%) Số điểm 1 2 3 LIÊN KẾT HÓA HỌC - Thế nào là liên kết ion(liên kết cộng hoá trị).Cho ví dụ. - Viết CT e, CTCT, kiểu liên kết hoá học dựa vào hiệu độ âm điện. Số câu hỏi ½ ; 1 (12,5%) ½ ; 2 (12,5%) 1 (25%) Số điểm 1 1 2 PHẢN ỨNG HÓA HỌC 1 số các định nghĩa về phản ứng oxi hoá khử, phân loại phản ứng. Cách cân bằng phản ứng oxi hoá khử - Giải BT theo pp bảo toàn mol e Số câu hỏi ½ (12,5%) ½ (12,5%) 2 (25%) Số điểm 1 2 3 Tổng số câu hỏi (37,5%) 3/2 (37,5%) 2 (25%) 17 (100%) Tổng số điểm 3 4 3 10 TRƯỜNG THPT CHUYÊN BẮC KẠN KIỂM TRA HỌC KỲ 1 MÔN HOÁ LỚP 10 Hoá Điểm HỌ TÊN: ............................................................................ I/ Phần trắc nghiệm: (3 điểm) Hãy chọn đáp án đúng Câu 1: Nguyên tố sắt ở ô 26, cấu hình e của ion Fe3+ là: A. 1s22s22p63s23p63d6 B. 1s22s22p63s23p64s2 C. 1s22s22p63s23p63d54s2 D. 1s22s22p63s23p63d5 Câu 2: Số e độc thân của nguyên tử lưu huỳnh (Z=16) bằng: A. 1 B. 2 C. 3 D. 4 Câu 3: Một nguyên tố hoá học X ở chu kỳ 3, nhóm VA. Cấu hình e của nguyên tử X là: A. 1s22s22p63s23p2 B. 1s22s22p63s23p4 C. 1s22s22p63s23p3 D. 1s22s22p63s23p5 Câu 4: Trong phân tử CH4 nguyên tử C ở trạng thái lai hoá sp3. Phân tử CH4 có dạng : A. Tam giác phẳng B. Đường thẳng C. Tứ diện D. Vuông phẳng Câu 5: Cho các nguyên tố: Na (Z=11); O (Z=8) liên kết hoá học giữa Na và O thuộc loại: A. Liên kết cộng hóa trị B. Liên kết ion C. Liên kết cộng hoá trị phân cực D. Liên kết cộng hoá trị không phân cực Câu 6: Cho các nguyên tố: R(Z= 11), X(Z=17), Y( Z= 20). Số oxi hoá cao nhất của các nguyên tố trên lần lượt là A. +1, +5, +2 B. +1, +7, +2 C. +1, +3, +2 D. +1, +5, +1 Câu 7: Trong phản ứng 3NO2 + H2O 2HNO3 + NO. NO2 đóng vai trò gì? A. Chất oxi hoá B. Chất khử C. Chất oxi hóa và chất khử D. Cả A, B, C đều sai Câu 8: Số mol electron cần dùng để oxi hóa 2 mol Al thành 2 mol Al3+ là? A. 1 B. 3 C. 6 D. 4,5 Câu 9: Sự oxi hóa là: A. Sự kết hợp của một chất với hiđro B. Sự làm giảm số oxi hoá của một chất C. Sự làm tăng số oxi hoá của một chất C. Sự nhận eletron của một chất Câu 10: Cho quá trình Mn+7 + 5e Mn+2. Trong quá trình này: A. Mn+7 đóng vai trò là chất oxi hóa, bị khử thành Mn+2 B. Mn+7 đóng vai trò là chất khử, bị oxi hoá thành Mn+2 C.Mn+2 đóng vai trò là chất khử, bị oxi hoá thành Mn+7 D. Mn+2 đóng vai trò là chất oxi hoá, bị khử thành Mn+7 Câu 11: Phương trình hoá học nào sau đây là phản ứng oxi hóa khử? A 2O3 3O2 B. CaO + CO2 CaCO3 C. 2Al + 3H2SO4 Al2(SO4)3 + 3H2 D. BaO + 2HCl BaCl2 + H2O Câu 12: 3. Dãy các hiđroxit được xếp theo chiều tăng dần tính axit là : A. H2SO4 ; H3PO4 ; H2SiO3 ; Al(OH)3 B. Al(OH)3 ; H2SiO3 ; H3PO4 ; H2SO4 C. Al(OH)3 ; H2SiO3 ; H2SO4 ; H3PO4 D. Al(OH)3 ; H3PO4 ; H2SiO3 ; H2SO4 II/ Phần tự luận: (7điểm) Câu 1: (1,5 điểm) a. Nguyên tố X có tổng số hạt bằng 58, số hạt mang điện nhiều hơn số hạt không mang điện là 18 hạt. Xác định điện tích hạt nhân, số khối và viết kí hiệu nguyên tử nguyên tố X b. Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Viết cấu hình electron đầy đủ của nguyên tử R. Cho biết vị trí của R trong bảng tuần hoàn các nguyên tố hoá học. Câu 2: (1điểm) Hoàn thành các phương trình phản ứng hoá học sau bằng phương pháp thăng bằng electron. 1. C + HNO3 CO2 + NO + H2O 2. Cl2 + KOH KCl + KClO3 + H2O Câu 3: (1,5 điểm) Cho 3,6 gam một kim loại thuộc nhóm IIA tác dụng vừa đủ với dung dịch HCl, thu được 3,36 lil khí H2(đktc) và 53,3 gam dung dịch A. a. Xác định tên kim loại b. Tính nồng độ phần trăm của dung dịch axit đã dùng Câu 4: (1,5 điểm)Lấy 3,84 gam Cu đem hoà vào dung dịch HNO3 loãng dư thì thu được V lít khí NO (đktc). Tính V và số gam HNO3 nguyên chất đã phản ứng. Câu 5: (1,5 điểm) Nêu hiện tượng xảy ra, giải thích (theo bản chất của phản ứng oxihoá khử) và viết phương trình phản ứng khi cho một viên kẽm vào ống nghiệm có chứa 2ml dung dịch HCl. HƯỚNG DẪN CHẤM Phần trắc nghiệm: (3 điểm) Mỗi ý 0,25 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 ĐA D B C C B B C C C A C B Phần tự luận Câu 1 1,5 điểm a, ta có => p = 19, e = 19 , n = 20 Z = 19; A = 39 Kí hiệu Z là K b, Cấu hình e của nguyên tử R là: 1s22s22p63s23p63d34s2 Vị trí của R trong BTH: STT-23; chu kỳ 4; nhóm V B 0,5 0,5 0,5 Câu 2 1,0 điểm Cân bằng đúng mỗi phương trình 0,5 điểm 1,0 Câu 3 1,5 điểm a, Gọi kim loại cần tìm là R ta có: R – 2e R2+ 2H+ + 2e H2 0,3 0,15 => = 0,3 => MR = 24 vậy R là Magiê b, Nồng độ của axit đã dùng là: C% = = 26,735% 0,5 0.5 0,5 Câu 4 1,5 điểm Ta có Cu – 2e Cu2+ N+5 + 3e NO 0,06 0,12 0,12 0,04 Vậy V = 0,04.22,4 = 0,896 lít mHNO3 = (0,12 + 0,04).63 = 10,08 gam 0,5 0,5 0,5 Câu 5 1,5 điểm Hiện tượng: Trên bề mặt của viên kẽm có bọt khí bám vào tăng dần và thoát ra khỏi dung dịch, viên kẽm tan dần ra - Giải thích hiện tượng: do trong dung dịch có ion H+ đã oxihoá được Zn, ion H+ di chuyển đến bề mặt viên Zn để nhận e của Zn tạo thành phân tử H2 bám vào bề mặt viên Zn và thoát ra khỏi dd, đồng thời nguyên tử Zn bị oxihóa nhường e cho ion H+ tạo thành ion Zn2+ di chuyển vào trong dd, do đó viên Zn tan dần ra PTPU: Zn + 2HCl ZnCl2 + H2 0,5 0,5 0,5
File đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_10_co_dap_an.doc
de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_10_co_dap_an.doc

