Đề kiểm tra 1 tiết Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra 1 tiết Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra 1 tiết Học kì I môn Hóa học Lớp 11 năm học 2012- 2013 (Có đáp án)
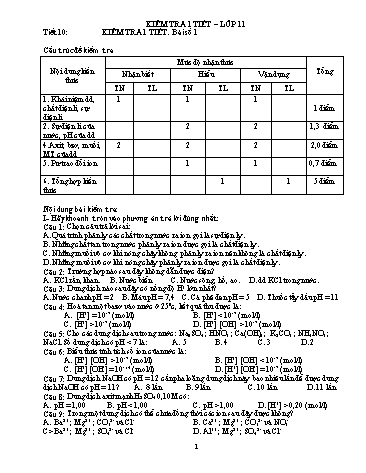
KIỂM TRA 1 TIẾT – LỚP 11 Tiết 10: KIỂM TRA 1 TIẾT. Bài số 1 Cấu trúc đề kiểm tra Nội dung kiến thức Mức độ nhận thức Tổng Nhận biết Hiểu Vận dụng TN TL TN TL TN TL 1. Khái niệm dd, chất điện li, sự điện li 1 1 1 1 điểm 2. Sự điện li của nước, pH của dd 2 2 1,3 điểm 4.Axit, bzơ, muối, MT của dd 2 2 2 2,0 điểm 5. Pư trao đổi ion 1 1 0,7 điểm 6. Tổng hợp kiến thức 1 1 5 điểm Nội dung bài kiểm tra: I- Hãy khoanh tròn vào phương án trả lời đúng nhất: Câu 1: Chọn câu trả lời sai: A. Quá trình phân ly các chất trong nước ra ion gọi là sự điện ly. B. Những chất tan trong nước phân ly ra ion được gọi là chất điện ly. C. Những muối vô cơ khi nóng chảy không phân ly ra ion nên không là chất điện ly. D. Những muối vô cơ khi nóng chảy phân ly ra ion được gọi là chất điện ly. Câu 2: Trường hợp nào sau đây không dẫn được điện? A. KCl rắn, khan. B. Nước biển C. Nước sông, hồ, ao. D. dd KCl trong nước. Câu 3: Dung dịch nào sau đây có nồng độ H+ lớn nhất? A. Nước chanh pH = 2 B. Máu pH = 7,4 C. Cà phê đen pH = 5 D. Thuốc tẩy dầu pH = 11 Câu 4: Hoà tan một bazơ vào nước ở 250c, kết quả thu được là: A. [H+] = 10-7 (mol/l) B. [H+] < 10-7 (mol/l) C. [H+] > 10-7 (mol/l) D. [H+] [OH-] > 10-7 (mol/l) Câu 5: Cho các dung dịch sau trong nước: Na2SO4 ; HNO3 ; Ca(OH)2 ; K2CO3 ; NH4NO3 ; NaCl. Số dung dịch có pH < 7 là: A. 5 B. 4 C. 3 D. 2 Câu 6: Biểu thức tính tích số ion của nước là: A. [H+] [OH-] > 10-7 (mol/l) B. [H+] [OH-] < 10-7 (mol/l) C. [H+] [OH-] = 10-14 (mol/l) D. [H+] [OH-] = 10-7 (mol/l) Câu 7: Dung dịch NaOH có pH = 12 cần pha loãng dung dịch này bao nhiêu lần để được dung dịch NaOH có pH = 11? A. 8 lần B. 9 lần C. 10 lần D. 11 lần Câu 8: Dung dịch axit mạnh H2SO4 0,10M có: A. pH = 1,00 B. pH 1,00 D. [H+] > 0,20 (mol/l) Câu 9: Trong một dung dịch có thể chứa đồng thời các ion sau đây được không? A. Ba2+ ; Mg2+ ; CO32- và Cl- B. Ca2+ ; Mg2+ ; CO32- và NO3- C> Ba2+ ; Mg2+ ; SO42- và Cl- D. Al3+ ; Mg2+ ; SO42- và Cl- Câu 10: Trộn 150 ml dung dịch NaOH 0,2M với 100 ml dung dịch H2SO4 0,1M thu được dung dịch X. Dung dịch X có: A. pH = 14,6 B. pH = 12,6 C. pH = 11,5 D. Không xác định được Câu 11: Phản ứng nào sau đây không xảy ra? A. HNO3 + Al(OH)3 B. CaCO3 + HCl C. Mg(NO3)2 + NaOH D. NaNO3 + BaCl2 Câu 12: Phương trình ion rút gọn của phản ứng cho biết: A. Những ion nào tồn tại trong dung dịch. B. Nồng độ những ion nào trong dung dịch lớn nhất. C. Không tồn tại trong dung dịch cacsc chất điện ly. D. Bản chất của phản ứng trong dung dịch các chất điện ly. Câu 13: Dung dịch Y có chứa: 0,15 mol Al3+ ; 0,35 mol NO3- ; x mol SO42- và 0,4 mol Na+. Giá trị của x và khối muối trong dung dịch Y lần lượt là: A. 0,3 và 57,55 B. 0,6 và 55,75 C. 0,25 và 58,95 D. 0,2 và 58,95 Câu 14: Axit ba nấc là: A. Axit H3PO4 B. Axit HCl C. Axit H2SO4 D. Axit HNO3 Câu 15: Chất nào sau đây thuộc loại muối axit? A. NaCl B. KNO3 C. NaHSO4 D. NaHPO3 II- Bài tập: Câu 1: Viết phương trình phân tử và ion rút gọn của phản ứng xảy ra. a) Bari clorrua + Natri sunfat b) Sắt (III) hiđroxit + Axit nitric c) Mg + axit sunfuric đặc, nóng d) Axit phophoric + ? Canxi hiđro photphat + Câu 2: Trộn 250 ml dung dịch hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch Ba(OH)2 a mol/l được dung dịch X có pH = 11. Tính a Thang điểm: I- Phần trắc nghiệm: 15 câu ( 5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 ĐA C A A B D C C B D B D D C A C II- Bài tập: Câu 1: (2 điểm). + Viết đúng PT phân tử và ion: mỗi ý 0,5 điểm Câu 2: (3 điểm). Số mol H+ = 0,025 Số mol OH- = 0,5a Dung dịch có pH = 12 dư bazơ Dung dịch có pH = 12 [H+] = 10-12 [OH-] = 10-2 Số mol OH- dư = 0,005 PT ion: H+ + OH- H2O Ban đầu 0,025 0,5a Pư 0,025 0,025 Sau pư 0 0,5a – 0,025 0,5a – 0,025 = 0,005 a = 0,06 Tiết 23: KIỂM TRA 1 TIẾT . Bài số 2 Cấu trúc đề kiểm tra Nội dung kiến thức Nhận biết Thông hiểu Vận dụng Tổng điểm TN TL TN TL TN TL Nitơ, amoniac và muối amoni 1 1 1 0,78 Axit nitric và muối nitrat 1 2 0,75 Photpho và hợp chất của photpho 1 1 2 1,0 Phân bón hoá học 1 0,25 Tổng hợp 2 1 1 0,5 + 6 Tổng cộng 3 5 1 5 1 10 Nội dung bài kiểm tra: Trắc nghiệm khách quan (4 điểm) Câu 1. Khi cho dung dịch NH3 đến dư vào dung dịch MgCl2 hiện tượng quan sát được là: A. có kết tủa xanh tan dần thành dung dịch màu xanh. B. có kết tủa keo trắng xuất hiện, không tan. C. không có hiện tượng gì. D. có kết tủa keo trắng xuất hiện sau đó kết tủa tan . Câu 2. Cho sơ đồ sau: Cu + HNO3 đặc ® Cu(NO3)2 + X + H2O . X là khí nào sau đây? A. NO. B. H2. C. N2O D. NO2. Câu 3. Cho dd có chứa 0,15 mol KOH vào dd có chứa 0,1 mol H3PO4. Muối thu được sau phản ứng là: A. K2HPO4 và KH2PO4. C. K3PO4 và KH2PO4. B. K2HPO4 và K3PO4 D. KH2PO4, K2HPO4 và K3PO4. Câu 4. Dung dịch H3PO4 chứa những phần tử : A. PO43-, HPO43-, H2PO4-. B. H+, OH-, PO43- C. H3PO4 , PO43-, HPO43-, H2PO4-, H+. D. HPO42-, H2PO4-, H+, PO43- Câu 5. Công thức hoá học của supephotphat đơn là: A. Ca3(PO4)3. B. Ca(H2PO4)2. C. CaHPO4 và CaSO4. D. Ca(H2PO4)2 và CaSO4. Câu 6. Cho các phản ứng sau: (1) FeCl3 + 3NH3 + 3H2O ® Fe(OH)3 ¯ + 3NH4Cl (2) NH3 + 3O2 ® 2N2 + 6H2O (3) 2NH3 + 3Cl2 ® N2 + 6HCl (4) 2NH3 + H2SO4 ® (NH4)2SO4 Số phản ứng NH3 thể hiện tính khử là A. 4 B. 3 C. 2 D. 1 Câu 7. Dãy các chất nào sau đây khi nhiệt phân đều thu được oxit kim loại? A. Al(NO3)3, NaNO3, Cu(NO3)2. B. Al(NO3)3, AgNO3, Cu(NO3)2. C. Mg(NO3)2, KNO3, Cu(NO3)2. D. Zn(NO3)2, Fe(NO3) 3, Cu(NO3)2. Câu 8. Đốt cháy hoàn toàn 6,2 gam photpho trong oxi dư, sau đó hoà tan sản phẩm vào 200 ml dung dịch NaOH 2,5 M được dung dịch A. Dung dịch A có chứa các chất: A. H3PO4 và NaH2PO4 B. NaH2PO4 và Na2HPO4 C. Na2HPO4 và Na3PO4 D. Na3PO4 và NaOH Câu 9. Từ 1,5 mol NH3 thực hiện phản ứng điều chế axít HNO3 với hiệu suất toàn bộ quá trình là 85% thì thu được m gam HNO3 . Tính m = ? A. 63 gam B. 64,26 gam C. 80,325 gam D. Kết quả khác. Câu 10. Chỉ dùng dung dịch nào dưới đây đê phân biệt 4 dung dịch: NH4Cl ; NaCl ; (NH4)2SO4; Mg(NO3)2 không màu đựng trong 4 lọ mất nhãn. A. BaCl2. B. Ba(OH)2. C. NaOH D. AgNO3. Câu 11. Axit HNO3 phản ứng được với tất cả các chất trong dãy nào sau đây? A. CaO ; NH3 ; Au ; FeCl2. B. Fe(OH)2 ; CuO ; NH3 ; Pt. C. Fe(OH)2 ; CO2 ; NH3 ; Au. D. Fe(OH)2 ; CuO ; NH3 ; Ag. Câu 12. Người ta có thể dùng thùng bằng sắt để đựng axit: A. HCl, dd H2SO4 loãng B. HNO3 đặc,nguội ,H2SO4 đặc,nguội. C. H2SO4 đặc,nóng, dd HNO3 loãng. D. HNO3 loãng, ddHCl II- BÀI TẬP: Câu 1: Hoàn thành các phương trình phản ứng theo sơ đồ sau: N2 ® ? ® (NH4)2SO4 ® NH3 ? ® Fe2O3 ® Fe(NO3)3 Câu 2: Hoà tan hoàn toàn 14 gam kim loại Fe vào 750 ml dung dịch HNO3 thu được hỗn hợp X gồm 2 khí NO và N2 có tỷ khối hơi so với H2 là 14,83. a) Viết phương trình phản ứng. Tính thể tích của mỗi khí (đktc) trong hỗn hợp X. b) Xác định nồng độ mol/l của dung dịch HNO3 đã dùng? Cho: H = 1 ; O = 16 ; N = 14 ; Cu = 64 ; Mg = 24 ; Cl = 35,5, Fe = 56. ĐA chấm: Phần TN khách quan: (5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 11 12 ĐA B A C C D C D C C B D B Phần tự luận:(5 điểm) Câu 1: (3 điểm) N2 + 3H2 2NH3 2 NH3 + H2SO4 (NH4)2SO4 (NH4)2SO4 + NaOH Na2SO4 + 2NH3 + 2H2O 3NH3 + 3H2O + FeCl3 Fe(OH)3 + 3 NH4Cl 2Fe(OH)3 Fe2O3 + 3H2O Fe2O3 + 6HNO3 2Fe(NO3)3 + 3H2O Câu 2: (3 điểm) Số mol Fe = 0,25 mol ; = 29,66 PTPư: Fe + 4HNO3 Fe(NO3)3 + NO + 2H2O Mol: x 4x x 10Fe + 36HNO3 10e(NO3)3 + 3N2 + 18H2O Mol: 10y/3 3,6y y Ta có: VNO = 0,15 . 22,4 = 3,36 lít ; VN2 = 0,03 . 22,4 = 0,672 lít b) Số mol HNO3 = 4x + 3,6y = 0,708 mol [HNO3] = = 0,944 M Tiết 38: KIỂM TRA HỌC KỲ I I- Hãy khoanh tròn vào phương án trả lời đúng nhất. Câu 1: Cho 0,015 mol H3PO4 và dung dịch chứa 0,06 mol NaOH. Dung dịch thu được sau phản ứng có chứa các chất tan là: A. NaH2PO4 , Na2HPO4 B. NaH2PO4 , Na3PO4 C. Na3PO4 , NaHPO4 D. Na3PO4 , NaOH Câu 2: Cho sơ đồ phản ứng sau: A B D E. Các chất A và E trong sơ đồ là: A. N2 , NH3 B. NO , HNO3 C. NH3 , HNO3 D. N2 , NH4NO3 Câu 3: Dung dịch sau đây trong nước đều có pH < 7 là: A. KOH. B. NaHSO4 C. Na2SO4 D. CaS. Câu 4: Nhóm nào gồm tất cả các chất vừa thể hiện tính oxi hoá, vừa thể hiện tính khử ? A. N2, Si, C. B. CO2, HNO3, CO C. NH3, NO, CO2 D. HCl, SiO2, Si. Câu 5: Nhóm gồm tất cả các anion đều tạo kết tủa với cation Mg2+ là A. , Cl–, . C. , , . B. , , Br–. D. , , , . Câu 6: Hoà tan hoàn toàn 11,2 gam Fe trong dd HNO3 đặc, đun nóng thu được thể tích khí thoát ra ở đktc là: A. 8,96 lít B. 13,44 lít C. 4,48 lít D. 17,92 lít Câu 7: Trong phản ứng với các chất nào dưới đây NH3 thể hiện tính khử ? A. NH3 + HCl NH4Cl B. 2NH3 + 3CuO N2 + 3Cu +3H2O C. 3NH3 + 3H2O + FeCl3 Fe(OH)3 + 3NH4Cl D. NH3 + HNO3 NH4NO3 Câu 8: Thuốc thử để nhận biết tất cả các dung dịch sau: NH4NO3 ; KNO3 ; NH4)2SO4 ; Mg(NO3)2 đựng trong các lọ mất nhãn là: A. dd NaOH B. dd Ba(OH)2 B. dd NH3 D. dd BaCl2. Câu 9: Trong phản ứng với các chất nào sau đây HNO3 thể hiện tính oxi hoá ? A. Fe(OH)2 B. Fe(OH)3 C. Fe2O3 D. MgCO3 Câu 10: Phản ứng nào sau đây viết sai ? A. Si + 2NaOH + H2O Na2SiO3 + 2H2 B. Mg + 4HNO3 Mg(NO3)2 + N2O5 + 2H2O C. SiO2 + 2NaOH đặc Na2SiO3 + 2H2O D. SiO2 + 2Mg Si + 2MgO Câu 11: Nhận xét nào sâu đây không đúng? A. Tất cá các muối nitrat đều tan trong nước. B. Các muối nitrat đều là chất điện ly mạnh, khi tan trong nước phân ly ra cation kim loại và anion gốc nitrat. C. Các muối nitrat đều dễ bị phân huỷ bới nhiệt. D. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hoá đỏ. Câu 12: Đối với dung dịch axit yếu CH3COOH 0,1M, nếu bỏ qua sự điện ly của nước thì đánh giá nào về nồng độ mol/l của ion H+ là đúng? A. [H+] = 0,1M B. [H+] > [CH3COO-] C. [H+] 0,1M Câu 13: Cặp chất nào sau đây cùng tồn tại trong một dung dịch? A. Axit nitric và đồng oxit. B. Bari hiđroxit và axit photphoric. C. Amoni sunphat và natri hiđroxit. D. Canxi cacbonat và natri hiđroxit. Câu 14: Công thức của phân Đạm ure là: A. NH4Cl B. NH4NO3 C. (NH2)2CO D. (NH4)2HPO4 Câu 15: Dung dịch A có [OH-] = 1,5.10-5M. Môi trường của dung dịch A là: A. Axit B. Bazơ C. Trung tính D. Lưỡng tính II- Phần tự luận: Câu 1 (1,5 điểm) Viết phương trình phân tử của phản ứng xảy ra ứng với 2 phương trình ion rút gọn sau: a) H+ + S2– H2S b) 3FeO + 10H+ + 3Fe3+ + NO+ 5H2O Câu 2 (1,0 điểm) Axit silixic H2SiO3 là axit yếu, yếu hơn axit cacbonic. Viết phương trình phản ứng để chứng minh? Câu 3: (2,5 điểm) Hoà tan hết a gam Al trong dung dịch axit HNO3 loãng thu được dung dịch X và 1,12 lít hỗn hợp khí Y (đktc) gồm NO và N2 có khối lượng 1,44 gam. Viết các phương trình phản ứng xảy ra, tính a. ĐA CHẤM Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Đa D C B A C B B B A B D C D C B II- Phần tự luận: Câu 1 (1,5 điểm) Viết phương trình phân tử của phản ứng: a) 2HCl + Na2S NaCl + H2S H+ + S2– H2S b) 3FeO + 10HNO3 3Fe(NO3)3 + NO+ 5H2O 3FeO + 10H+ + 3Fe3+ + NO+ 5H2O Câu 1 (1,0 điểm) Axit silixic H2SiO3 là axit yếu, yếu hơn axit cacbonic: Na2SiO3 + H2O + CO2 Na2CO3 + H2SiO3 Câu 3: (2,5 đ) Đặt số mol NO = x; Số mol N2O =y Ta có (1,0 đ) Al + 4HNO3 Al(NO3)3 + NO + 2H2O Mol: 0,02 0,02 10Al + 36HNO3 10Al(NO3)3 + 3N2 + 15H2O (1,0 đ) Mol: 0,1 0,03 a = 0,12 . 27 = 3,24 g (0,5 đ)
File đính kèm:
 de_kiem_tra_1_tiet_hoc_ki_i_mon_hoa_hoc_lop_11_nam_hoc_2012.doc
de_kiem_tra_1_tiet_hoc_ki_i_mon_hoa_hoc_lop_11_nam_hoc_2012.doc

